Différence entre l'acide acétique et l'acide acétique glaciaire
- 4950
- 1183
- Mlle Lina Schmitt
Qu'est-ce que l'acide acétique?
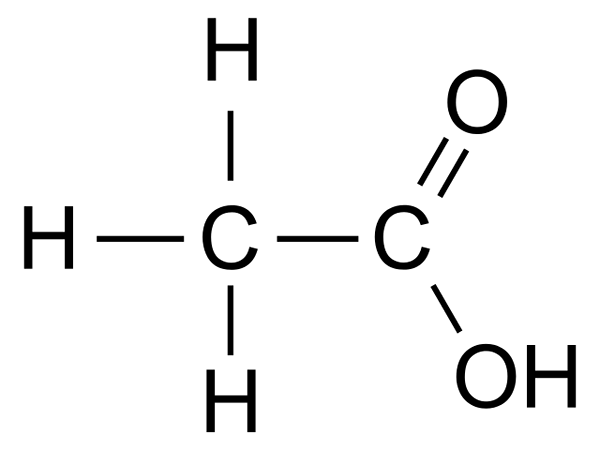
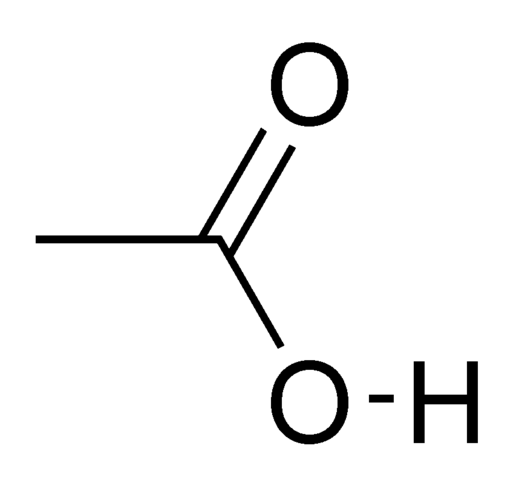
L'acide acétique (CH3COOH) est l'un des acides carboxyliques les plus simples. Sous la nomenclature du système IUPAC, le nom de l'acide acétique est l'acide éthanoïque.
L'acide acétique est synthétisé en décomposition et en fermentation acétique. Dans la nature, il se trouve dans les organismes végétaux et animaux, à la fois dans un état libre et sous la forme d'esters et d'autres dérivés.
Dans le passé, l'acide acétique a été produit par la fermentation acétique de l'alcool éthylique contenu dans le vin. Par l'action des enzymes bactériennes, l'alcool du vin est oxydé par l'oxygène de l'air en acide acétique.
La méthode industrielle pour la production d'acide acétique est l'oxydation catalytique directe de l'acétaldéhyde ou du butane. Il peut également être produit industriellement par la carbonylation du méthanol, catalysé par le rhodium-iode.
L'acide acétique est un liquide incolore avec une odeur piquante et un goût aigre. Il se dissout très bien dans l'eau. En raison de la plus grande polarité de la liaison, les acides carboxyliques O-H forment des liaisons hydrogène intermoléculaires plus fortes que les alcools, ce qui détermine la solubilité sans restriction de l'acide acétique.
Les propriétés chimiques de l'acide acétique sont déterminées par son groupe fonctionnel carboxyle et par la fraction méthyl. L'acide participe aux réactions chimiques avec une rupture des liaisons dans le groupe carboxyle.
L'acide acétique montre les propriétés chimiques typiques des acides organiques. Dans la solution d'eau, l'acide acétique est dissocié en fonction de l'équation:
Ch3COOH → CH3COO¯ + H
Le degré de dissociation électrolytique est significativement inférieur à celui des acides inorganiques forts, donc l'acétique est un acide faible. Il réagit avec des métaux hautement électropositifs, des oxydes de base, des hydroxydes de base et des sels d'acides plus faibles. Les sels obtenus sont appelés acétates (éthanoates).
Les réactions avec les oxydes, les hydroxydes et les sels rompent la liaison O-H dans le groupe carboxyle.
La réaction de l'acide acétique avec des alcools en présence d'acides forts est appelée estérification, elle conduit à la production d'esters.
L'acide acétique participe également à des réactions affectant le groupe méthyle - réactions de substitution dans la fraction d'hydrocarbures.
Sous forme de vinaigre, des solutions d'acide acétique (5 à 18%) sont utilisées dans l'industrie alimentaire et dans les ménages. L'acide acétique est utilisé pour la fixation des films photographiques, pour éliminer les dépôts de calcium des grues et des chaudières, pour traiter une piqûre de méduse, etc. Il est également utilisé comme conservateur pour l'ensilage, car il inhibe la croissance des bactéries et des champignons.
Qu'est-ce que l'acide acétique glaciaire?
L'acide acétique pur et anhydre est un liquide hygroscopique incolore. À des températures inférieures à 16.7 ° C, il forme des cristaux en forme de glace. C'est pourquoi ça s'appelle l'acide acétique glaciaire.
L'acide acétique glaciaire bout à haute température (118 ° C). La raison en est la formation de liaisons hydrogène stables entre deux molécules d'acide acétique sous la forme d'un dimère cyclique. Le point de l'inflammabilité est de 39 ° C. La densité à 25 ° C est 1.05 g / ml.
Pendant des siècles, les chimistes ont pensé que l'acide acétique glacial et l'acide dans le vinaigre sont deux substances différentes.
L'acide acétique glaciaire est corrosif et ses vapeurs irritent les yeux et le nez. En contact avec les yeux et la peau, cela peut entraîner des blessures.
Au contact de l'acide acétique avec de l'acide acétique glaciaire cristallisé, l'acide acétique pur s'attache au cristal.
L'acide acétique glaciaire est un excellent solvant de base polaire. Il est souvent utilisé dans la production de:
- Acide téréphtalique;
- Propylène téréphtalate;
- Camphre synthétique;
- Aniline.
Différence entre l'acide acétique et l'acide acétique glaciaire
-
Définition
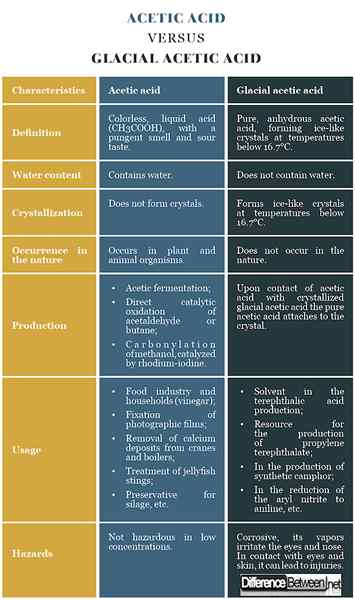
Acide acétique: L'acide acétique est un acide liquide incolore (CH3COOH), avec une odeur piquante et un goût aigre.
L'acide acétique glacial: L'acide acétique anhydre pur, formant des cristaux de glace à des températures inférieures à 16.7 ° C, est appelé acide acétique glaciaire.
-
Teneur en eau
Acide acétique: L'acide acétique contient de l'eau.
L'acide acétique glacial: L'acide acétique glaciaire ne contient pas d'eau.
-
Cristallisation
Acide acétique: L'acide acétique ne forme pas de cristaux.
L'acide acétique glacial: À des températures inférieures à 16.7 ° C, l'acide acétique glaciaire forme des cristaux de glace.
-
Occurrence dans la nature
Acide acétique: Dans la nature, l'acide acétique se trouve dans les organismes végétaux et animaux.
L'acide acétique glacial: L'acide acétique pur et anhydre ne se produit pas dans la nature.
-
Production
Acide acétique: L'acide acétique peut être produit par fermentation acétique, par oxydation catalytique directe de l'acétaldéhyde ou du butane, et par carbonylation du méthanol, catalysé par la rhodium-iodine.
L'acide acétique glacial: Au contact de l'acide acétique avec de l'acide acétique glaciaire cristallisé, l'acide acétique pur s'attache au cristal.
-
Usage
Acide acétique: L'acide acétique est utilisé dans l'industrie alimentaire et dans les ménages (vinaigre); pour la fixation des films photographiques; pour éliminer les dépôts de calcium des grues et des chaudières; Pour traiter une piqûre de méduse, comme un conservateur pour l'ensilage, etc.
L'acide acétique glacial: L'acide acétique glaciaire est utilisé dans la production d'acide téréphtalique, téréphtalate de propylène, camphre synthétique, aniline, etc.
-
Dangers
Acide acétique: L'acide acétique n'est pas dangereux dans les faibles concentrations.
L'acide acétique glacial: L'acide acétique glaciaire est corrosif et ses vapeurs irritent les yeux et le nez. En contact avec les yeux et la peau, cela peut entraîner des blessures.
Différence entre l'acide acétique et l'acide acétique glaciaire: tableau de comparaison
Résumé de l'acide acétique vs acide acétique glaciaire
- L'acide acétique est un acide liquide incolore (CH3COOH), avec une odeur piquante et un goût aigre.
- L'acide acétique anhydre pur, formant des cristaux de glace à des températures inférieures à 16.7 ° C, est appelé acide acétique glaciaire.
- L'acide acétique contient de l'eau, tandis que l'acide acétique glaciaire ne.
- L'acide acétique ne forme pas de cristaux, tandis qu'à des températures inférieures à 16.7 ° C, l'acide acétique glaciaire forme des cristaux de glace.
- Dans la nature, l'acide acétique se trouve dans les organismes végétaux et animaux. L'acide acétique pur et anhydre ne se produit pas dans la nature.
- L'acide acétique peut être produit par fermentation acétique, par oxydation catalytique directe de l'acétaldéhyde ou du butane, et par carbonylation du méthanol, catalysé par la rhodium-iodine. Au contact de l'acide acétique avec de l'acide acétique glaciaire cristallisé, l'acide acétique pur s'attache au cristal.
- L'acide acétique est utilisé dans l'industrie alimentaire et dans les ménages (vinaigre); pour la fixation des films photographiques; pour éliminer les dépôts de calcium des grues et des chaudières; pour traiter une piqûre de méduse; comme conservateur pour l'ensilage, etc.
- L'acide acétique glaciaire est utilisé dans la production d'acide téréphtalique, téréphtalate de propylène, camphre synthétique, aniline, etc. etc.
- L'acide acétique n'est pas dangereux dans les faibles concentrations. L'acide acétique glaciaire est corrosif et ses vapeurs irritent les yeux et le nez. En contact avec les yeux et la peau, cela peut entraîner des blessures.

